ニュース
-
自主回収のご案内
2025/06/20
-
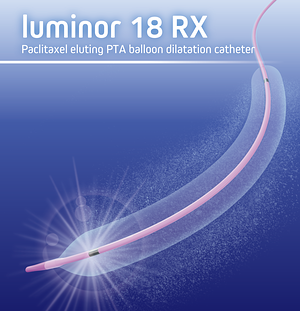
luminor 18RX Paclitaxel eluting PTA balloon dilatation catheter 発売のご案内
2025/04/01
luminor 18RX Paclitaxel eluting PTA balloon dilatation catheterを発売しましたので、ご案内いたします。
販売名:MHルミノール薬剤コーティングバルーンカテーテル
承認番号:30700BZX00044000本製品は、浅大腿動脈及び/又は近位膝窩動脈における、新規病変又は非ステント留置再狭窄病変を有する患者に使用する
薬剤(パクリタキセル)コーティングバルーンカテーテルになります。
海外臨床試験及び、国内治験(SOL JAPAN Trial)において、
安全性、有効性が評価されました。(詳しくは、最寄りの弊社支店営業所へお問い合わせください)
-
Litho EVO GI レーザ発売のご案内
2025/03/01
-
CRABCLAMP® +(クラブクランププラス) 発売のご案内
2025/02/20
-
九州支社及び九州支店移転のご案内
2025/02/10
令和7年2月10日より、下記住所へ九州支社及び九州支店を移転いたしましたのでご案内申し上げます。
移転を機に、サービスのさらなる向上をめざし皆様のご期待に沿えるよう努力してまいりますので、
今後とも変わらぬお引立てを賜りますようお願い申し上げます。新住所:〒812-0061
福岡県福岡市東区筥松2丁目18番10号 アーバンオフィス箱崎5階
電 話:092-592-2577(変更ございません)
FAX:092-592-2505(変更ございません)
業務開始日:令和7年2月10日(月) -
Penumbraアスピレーション システム RED043発売のご案内
2024/09/01
-
DeFrictorⓇZERO発売のご案内
2024/07/01
-
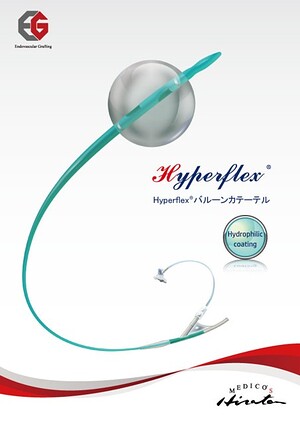
HyperflexⓇ バルーンカテーテル ラインナップ追加のご案内
2024/08/01
-
Penumbraアスピレーション システム RED072 with SENDit 発売のご案内
2024/07/01
-
自主回収のご案内
2024/07/24
販売名:MHサージェントサポートカテーテルの一部製品を自主回収することといたしました。詳細につきましては、添付:「医療機器回収の概要」をご確認ください。