薬事申請について
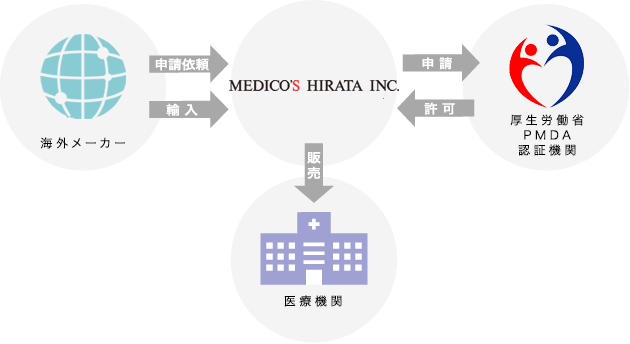
日本国内で医療機器の販売を行うには、厚生労働大臣や医薬品医療機器総合機構(PMDA)、認証機関に対して薬事申請を行い、承認や認証を受ける必要があります。
当社では、長年にわたって構築してきた関係機関や医療従事者の方々との信頼関係や蓄積してきたノウハウを活用し、適切な申請を行います。

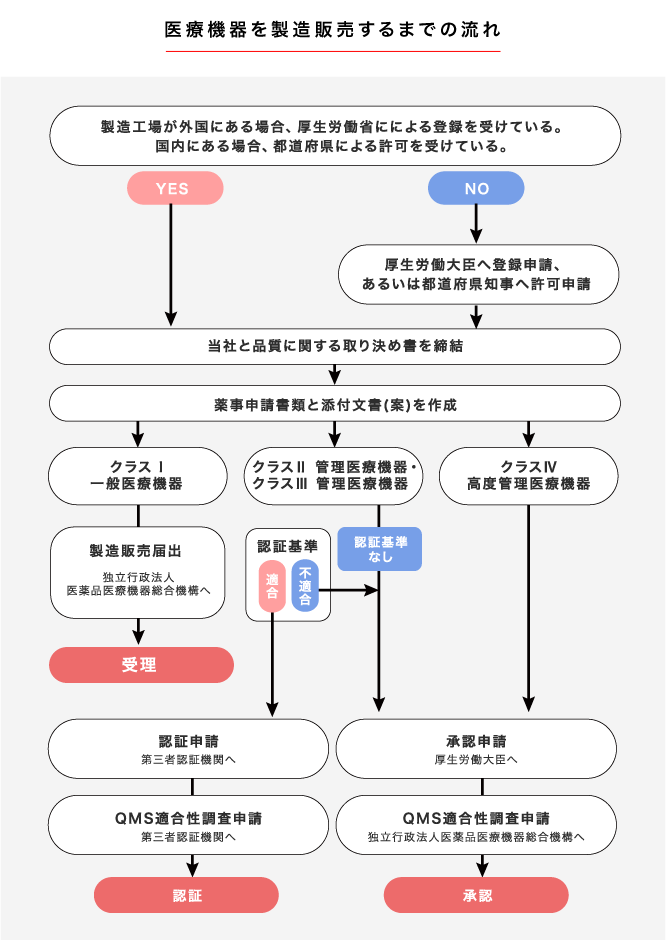
医療機器のクラス分類
| クラス分類 | 薬事手続 | |
|---|---|---|
| クラス I (一般医療機器) |
不具合が生じた場合でも、 人体へのリスクが極めて低いと考えられるもの |
届出 |
| クラス II (管理医療機器) |
不具合が生じた場合でも、 人体へのリスクが比較的低いと考えられるもの |
認証 または 承認 |
| クラス III (高度管理医療機器) |
不具合が生じた場合、 人体へのリスクが比較的高いと考えられるもの |
承認 または 認証 |
| クラス IV (高度管理医療機器) |
患者への侵襲性が高く、不具合が生じた場合、 生命の危険に直結する恐れがあるもの |
承認 |
適切な薬事申請

医療機器の性能、安全性、そして有効性という申請に必要な情報をグローバルに収集し、それらを適切なプロセスで行政へ申請いたします。申請手続きを「適切なタイミング」と「適切な方法」で行うために、開発から製品導入までのスケジュールをしっかり見据えながら、製造元や関連部署とも連携して申請作業を進めています。
治験デザインの立案から実施計画作成

日本では新しい医療デバイスやリスクの高い医療デバイスは臨床データが必要となります。他国の臨床データを利用することで承認を取得できる場合もありますが、新規性の高い医療デバイスやリスクの高い埋め込み型医療デバイスなどは、日本で治験を実施することが求められます。
当社は、治験デザインの立案から実施計画作成・治験実施・解析及び総括報告書作成まで、日本国内で治験を行う場合の全てのプロセスを実施することができます。
国際共同治験への取り組み
海外の最先端医療デバイスをいち早く日本に導入するために、治験国内管理人として、海外のスポンサーと共同して国際共同治験も行っております。さらに国際共同治験用の実施計画を完成させるために、海外のスポンサーに対して日本の治療実態、規制に合わせた提案をしています。
当社はこれまでCoronary stent,Vascular Graft, Endovascular Graft, Endovascular Laser, Intracranial Stent, SFA stent, Transcatheter Aortic Valveなどの治験実施経験があります。
900件を超える実績

当社は1978年から現在に至るまで900件を超える薬事申請の実績があり、申請する際に生じる様々な課題を解決するノウハウを保有しています。今でこそ電子的に管理していますが、行政手続きを1件1件記録した手書きのノートを「財産」とし、この財産と実績を当社の自負として取り組んでいます。
ニーズに応えるヒラタの機能
医療機器に関する様々なニーズにお応えするヒラタの機能についてご紹介します。